怎么看现在的三款国产新冠口服药?
个人观点,不代表任何组织与单位
这段时间经常有人问国产新冠口服药。有的比较含蓄,就留言几个字“国产3CL”,给我一种地下工作对暗号的感觉。有的特直接,留言“你就说吧,VV116到底有没有用”,问得我鸭梨山大。
其实,有没有用这个问题挺难回答的。为什么呢?因为“有用”二字如何定义?起安慰剂作用算不算有用?新冠感染早期WHO推荐程度最高的Paxlovid,应该是现在新冠口服药里的白月光了吧?但在临床试验里Paxlovid用药组里也有最后要住院的,对这些还是住院了的人,Paxlovid有用吗?
三个国产新冠口服药(只说抗病毒药,XX颗粒这种不在讨论范围):阿兹夫定,机理类似瑞德西韦的VV116和机理类似Paxlovid的3CL抑制剂先欣诺。这些药物写过不少分析数据的文章,这次放在一起,说一下该怎么看这些药物,包括它们的有效性,与国际上主流药物的可比性等等。
1. 为什么阿兹夫定不行?
三个药里面,一个我认为有充分的证据应该把它去掉,就是阿兹夫定。这个药本来是作为HIV药物研发,根据发表的数据,体外细胞实验里对新冠病毒的IC50是维摩水平,等于要非常高的浓度才能起抑制作用,体内不可能达到。而且发表出来的代谢分布,阿兹夫定主要集中在胸腺,新冠感染病毒是在呼吸系统为主,肺部连抗病毒的活性成分都检测不到[1],怎么可能有用?
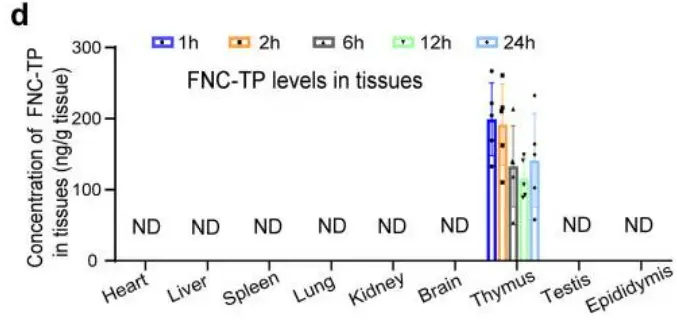
附图. 阿兹夫定的抗病毒活性成分在肺部(lung)检测不到(ND)
至于阿兹夫定做的临床试验,更是一言难尽。三期临床试验每次都计划招募300多人,如此少的计划招募人数,可能有足够的统计学效力吗?为什么它会这么设计试验,然后每次都能说做成功,是需要警惕的。
最近阿兹夫定又发了一篇真实世界研究,说在住院重症患者里也有效(轻症重症都有效,这一点也匪夷所思)。研究怎么做的呢?是国内一个医院总共1500多名住院患者,226人吃了阿兹夫定,找了226个没吃的做对照,比较疾病进展、病死率,最后说都是阿兹夫定更好[2]。
但很有意思,排除掉吃别的药这些不符合研究标准的人,潜在能用来对照的人总共就674个。
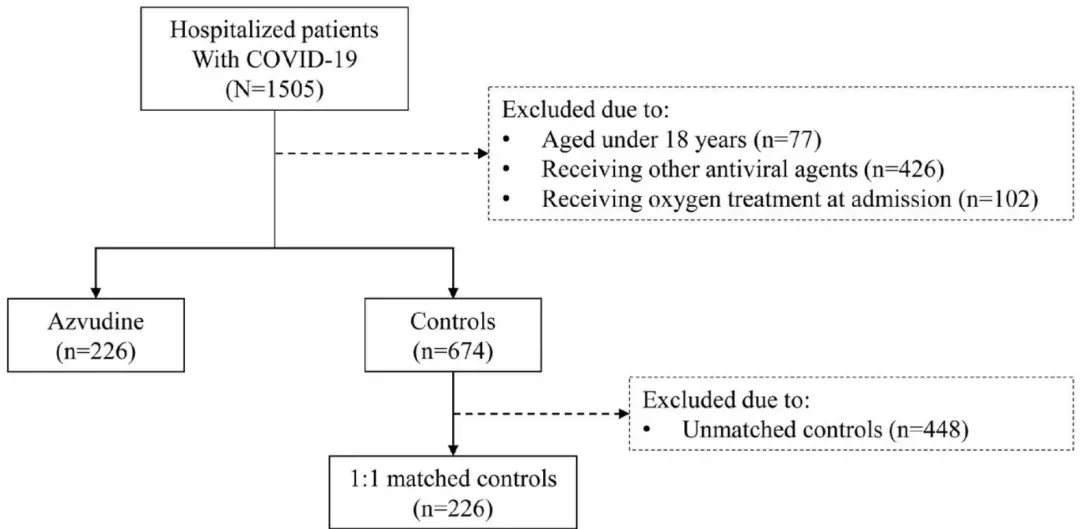
附图. 226个阿兹夫定使用者刚好找到226个对照
一般来说这种真实世界研究,找对照(如年龄性别病情相当,即matched control),往往要潜在对照多很多,才能保证每个用药组都能对上一个对照。很多时候会出现因为找不到对照,用药组一些人没法纳入。而另一些人对应的对照很多,这时会确定一个用药的人对应几个对照,多出来的随机排除。226个人用药,从600多个没吃阿兹夫定的人里不多不少精确找出226个对照,未免也太巧了吧?
阿兹夫定的数据,永远有那么多巧合,好像有人不断中六合彩。这种六合彩中出来的有效性能靠谱吗?更为关键的是安全性。这个药有很多实验证据指向存在生殖毒性、致突变性的风险,致癌性它没有做,但一般来说致突变性非常明确的情况下,致癌性也是逃不掉的。
确实,新冠用药疗程比较短,生殖毒性、致突变性风险会因此有部分缓和。可是这些风险是明确存在的,考虑到新冠在大部分身上不需要特殊治疗也能自愈,而且还有其它有效性更明确不带这些风险的药物,为什么还要用阿兹夫定呢?
或者说得再直白一点,为什么一定要用一个数据高度可疑,理论上不可能有效,且存在不可忽视的毒性风险的药物,来治疗一个很多推荐这个药物的专家们眼里已经是危险性大幅下降,和流感甚至感冒无异的上呼吸道感染呢?
所以,三个国产口服药里,为了健康,可以排除掉阿兹夫定。
2. VV116和先欣诺是否有效?
再转到最近刚上市,可能也是大家最关心的两个药:VV116和先欣诺。这两个和阿兹夫定不一样,我个人倾向于认为它们可能有效,但现在公布的有效性证据不足。
为什么说这两个药可能有效?因为它们两个不仅针对的靶点是被验证过的——VV116针对新冠病毒RNA复制酶RdRp,先欣诺针对3CL,这两个从分子上也和已经证实有效的瑞德西韦(RdRp)、Paxlovid(3CL)类似。验证过的靶点,相似的分子,自然增加了有效的几率。
先看VV116,它就是从瑞德西韦的前体GS-441524改的。而且吉列德在GS-441524的基础上还改过一个优化口服的版本GS-621763。我们看一下四个分子的化学结构:
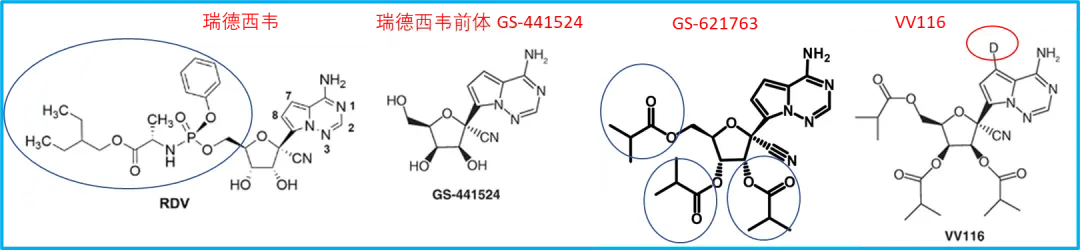
附图. 瑞德西韦、GS-441524、GS-621763与VV116化学结构
可以看到GS-441524是基础,瑞德西韦与GS-614763都是在它之上改动(蓝圈内为改动部分)。不过这些改动都没有改核心部分,也就是模仿ATP与病毒RdRp结合的核苷部分(瑞德西韦VV116都属于核苷类似物)。VV116实际上就是在GS-621763的基础上将一个普通氢原子改成了同位素氘(红圈内的D)。
在药物研发领域,VV116是GS-621763的氘代版本。氘代一般两个目的。一是改善药物的代谢特征,碳原子和氘的化学键比氢原子的化学键更稳定,有时候氘代药物会因此变得更稳定,不容易被代谢掉。不久前FDA批准的银屑病药物deucravacitinib就是利用了这一点的氘代药物。氘代的另一个常见目的是破解专利。氘代分子与原始分子属于不同的两个分子,这样有可能规避专利保护。
无论如何,VV116和GS-621763,与瑞德西韦非常类似,自然让VV116有可能在疗效上也模仿瑞德西韦。注意,我这里说的是有可能。
再来看先欣诺,这个药保密工作非常好,Pubmed上一篇论文都没有,化学结构之前也找不到,上市后这两天才有人贴出来。它是3CL抑制剂,和Paxlovid同靶点。先欣诺和Paxlovid一样,都用了老药利托纳韦改善药物代谢特征。起抗病毒作用的,先欣诺里是先诺特韦,Paxlovid里是nirmatrelvir,奈玛特韦。我们也来看一下这两个有效成分的化学结构:
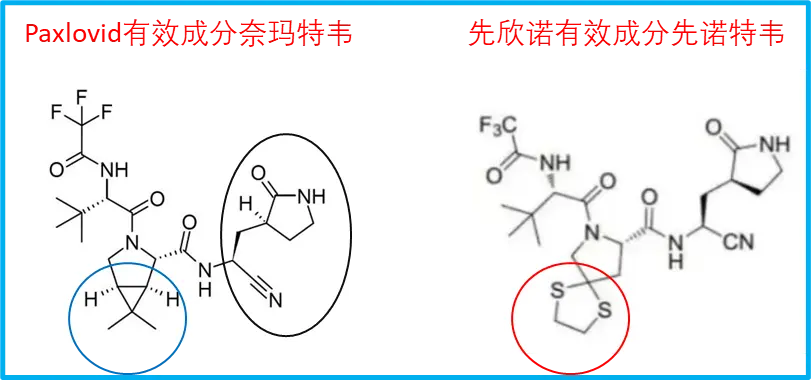
附图. Paxlovid与先诺欣抗病毒成分化学结构比较
奈玛特韦抑制3CL的关键结构是黑圈部分,那部分模拟了与3CL喜欢结合的谷氨酰胺(学术上管这类药物叫拟肽),里面的氮能和3CL蛋白活性中心的半胱氨酸结合(学术上称为弹头,warhead),起到抑制作用。
可以看到先诺特韦只是红圈部分与奈玛特韦的蓝圈部分稍有区别。和VV116一个道理,这种和验证有效的药物的高度相似,增加了先欣诺有效的可能性。
但是,共同的靶点,相似的分子,只是让VV116和先诺欣有可能有效,这两个药和真正证实有效的瑞德西韦、Paxlovid毕竟是不同的分子,仍然需要完善的验证才能确定有效性、安全性。而在验证的完善性上,国内这两个药至少已经公布的信息是有欠缺的。
3. 不能等同瑞德西韦与Paxlovid
就算是保留了瑞德西韦与奈玛特韦最终攻击病毒靶点RdRp和3CL的核心结构,我们要注意VV116和先诺特韦仍然是不同于“原版”的分子。不同的分子,即便是小改,也可能会带来抑制活性、代谢特征等方面的差异。因此也需要完善的验证才能明确有效性、安全性。
先诺欣公布的信息很少,可是这个药是750mg先诺特韦与100mg利托纳韦联用[3],对比之下Paxlovid中奈玛特韦是300mg。从更高的用量推测,先诺特韦可能是抑制新冠病毒的能力更弱,或者代谢特征更差(如口服利用率更低、更容易被血清蛋白结合等),造成需要用更高的剂量来抑制病毒。
VV116公布的信息更多一些,另外GS-441524的口服优化研究不少,包括VV116氘代的基础GS-621763有多篇研究发表[4-5]。其实我们可以想一下,瑞德西韦的原研药厂吉列德为什么没有选择推进GS-621763?
GS-621763是一个增加了口服利用度的GS-441524前药,进入人体后会转化为后者。但要真正抑制病毒,GS-441524需要经过磷酸化。
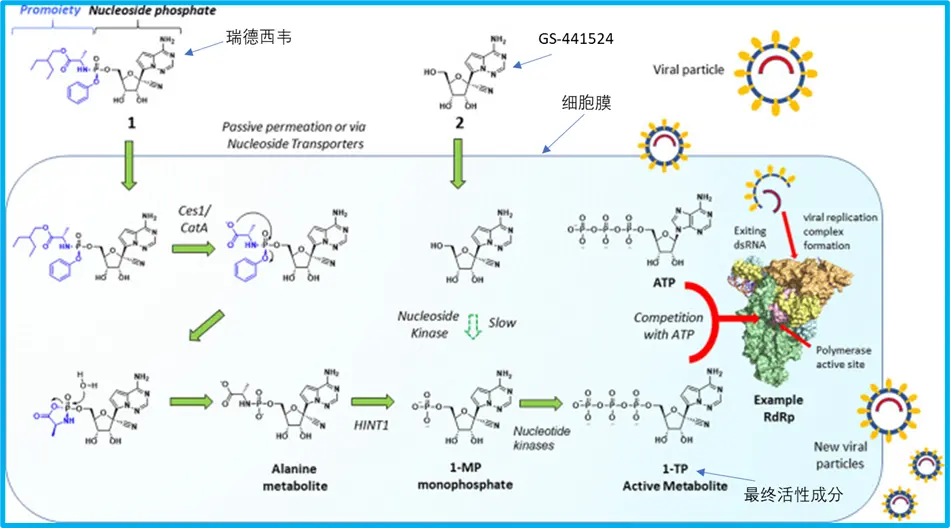
附图. 从瑞德西韦到最终活性成分(1-TP)的代谢过程
参考上图,最终抑制病毒的是1-TP,GS-441524转化到1-TP需经过1-MP,而细胞内转化为1-MP这一步效率较低,瑞德西韦虽然也是GS-441524改造而来,但恰恰绕过了GS-441524到1-MP这一步转化[6]。
因此,在GS-441524以及GS-621763的动物模型研究里,吉列德均发现即便两个口服药用了更高的剂量,肺部组织里的活性抗病毒成分1-TP仍低于瑞德西韦。与VV116极为类似的GS-621763,水貂模型里30mg/kg的GS-621763剂量对比10mg/kg的瑞德西韦,最终肺部的活性抗病毒成分(1-TP)仅为后者的四分之一[4]。
当然在上述水貂模型里,20mg/kg的GS-621763剂量对应人体每日使用250mg也显示了抑制病毒的作用。可潜在的抗病毒活性成分浓度差异,仍然意味着我们不能假设瑞德西韦有效,VV116也必然有效。
同样的道理也适用于先欣诺,药物代谢是个非常复杂的过程,不是每个药代谢特征差一些或者活性差一些,多吃一片就能解决问题的。两个分子再相似,毕竟不是同一个分子,需要独立、完善的验证。
4. 如何与先行者比
如今说到国产口服药,不少人会说平替,VV116平替瑞德西韦,先欣诺平替Paxlovid。可所谓的平替是基于数据,还是想象?
国产口服药乐于强调自主知识产权。可这自主知识产权到底有多强?吉列德2020年8月的一个专利里就列出了GS-621763的结构式,其中甚至明确提到了范畴包括氘代[7]:

加之GS-441524的专利更是多年前就属于吉列德,或许只有仔细检验各方多年来多个专利的具体内容才能确定谁具有知识产权。而先诺欣与Paxlovid的类似程度之高,是否真破解了专利也需要认真核查方能确认。
但我个人更关注的不是这两个药的知识产权状况,它们必然会被热衷平替的人们大力推广,而绝大部分中国普通老百姓,以后也必然会用这些“平替”——无论他(她)们本人是否愿意“平替”。君实和先声有没有足够的知识产权,会不会被GS-442524与奈玛特韦的专利持有方找茬,以及能不能在国际市场上分一杯羹等等,相比14亿人绝大部分将使用这两个药来说,根本不值一提。
在这种情势下,我更关注的是这两个药到底有什么样的数据?吉列德不是没有做瑞德西韦的口服药,VV116氘代的GS-621763,两篇论文,一篇2021年7月就投稿到Nature communications,另一篇2021年9月公布预印版。可是为什么最后吉列德没有推GS-621763到临床,选了另一个GS-441524的优化版本GS-5245?
或许GS-621763其实一样好,但是我们不能总把原专利持有方当傻子,默认自己能从别人的专利上改出个更好的。要知道一个专利上动辄几十上百个化合物,原研企业选择其中某一个而不选其它,大概率是有原因的。
VV116第一天用1200mg,第二天到第五天用600mg,先诺欣是每天1500mg先诺特韦。相比之下,瑞德西韦用于非住院人群(VV116的针对人群),第一天200mg,第2-3天100mg(VV116的口服利用率根据文献接近50%,考虑口服与静脉注射的差别后,实际药物暴露量还是会比瑞德西韦高出不少),Paxlovid每天600mg奈玛特韦。如果看吉列德几篇论文里对口服版瑞德西韦的分析,一个经常提到的点是担心口服版如果要起到抗病毒作用,需要较长时间内使用较高剂量的药物。
当然有可能只是吉列德想多了,可是毕竟最后用这远高于瑞德西韦与Paxlovid剂量的VV116与先欣诺的大概率都是中国人(其它国家只有乌兹别克斯坦批准了VV116)。难道中国人不该更仔细检查下数据吗?
现在VV116正式发表了一个很难说明有效性的与Paxlovid的头对头试验,另外一位专家表示自己领衔的VV116临床试验显示与安慰剂比症状减缓作用明显。当然这位非常出名的专家曾经说过一个老药可以治疗新冠,而该药抑制新冠病毒的浓度需要200维摩。先欣诺更是没有发表过任何一篇论文,只有上市后发布新闻稿说三期试验显示有效。
对于有些热衷平替的人来说,或许这些证据与专家发言就足够了。例如这个:
![但是我个人觉得,中国人做给中国人吃的用的东西,即便不要求比给国外的好,至少也一视同仁。图中提到的Paxlovid与molnupiravir,虽然没在中国做三期临床试验,但它们的试验是全球做的,像Paxlovid的试验全球300个试验点,亚洲国家就包括印度、日本、韩国、马来西亚与泰国[8]。难道真的能认为现在国产口服药的数据充分程度和Paxlovid、molnupiravir以及瑞德西韦一致了吗?](https://d.ifengimg.com/w1080_h213_q90_webp/x0.ifengimg.com/ucms/2023_05/C5A698EB3307DEF2266929065E2B274926A62D51_size174_w1080_h213.png)
但是我个人觉得,中国人做给中国人吃的用的东西,即便不要求比给国外的好,至少也一视同仁。图中提到的Paxlovid与molnupiravir,虽然没在中国做三期临床试验,但它们的试验是全球做的,像Paxlovid的试验全球300个试验点,亚洲国家就包括印度、日本、韩国、马来西亚与泰国[8]。难道真的能认为现在国产口服药的数据充分程度和Paxlovid、molnupiravir以及瑞德西韦一致了吗?
全球新冠口服药市场Paxlovid占比80%,molnupiravir大约20%。仅仅美国2022年就使用了670万个疗程的Paxlovid。国外这些先行者是可以找出很多缺点——例如Paxlovid的药物冲突问题,瑞德西韦的静脉注射不便,molnupiravir的有效性低潜在致突变风险不可忽略,等等。但现在它们积累了大量的真实世界安全性、有效性数据。
后来者要有一席之地,即便是同一靶点,分子类似,需要的不仅是理论上的“好”,更要有扎实完善的数据。
我认为VV116或先诺欣可能有效,但我无法认同以现有的证据就说这两个药安全有效。